Myosin – Ett viktigt motorprotein
Denna text är lite mer avancerad än de texter som jag vanligen brukar publicera, men jag tänkte att om jag ändå har texten att jag publicerar den här. 🙂
I cellen pågår många olika processer samtidigt. Detta kräver att olika saker, som exempelvis organeller och vesiklar, transporteras till rätt plats vid rätt tillfälle. Detta kräver robusta transportsystem. Ett av dessa system sköts med hjälp av myosin. Detta är dock inte den enda uppgift myosin har, utan vissa former av myosin deltar även i muskelkontraktion och annan liknande rörelse. Alla olika myosiner fungerar dock på samma sätt, det vill säga genom hydrolys av ATP för att röra sig längs aktinfilament.
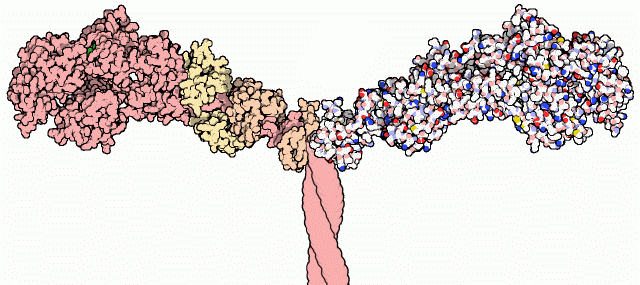
Myosinerna är en stor och viktig proteinfamilj. Dessa är generellt sett uppbyggda av en polypeptid, kallad den tunga myosinkedjan, med en huvuddomän, en halsdomän och en svansdomän. Till nackdomänen hos dessa polypeptider är olika essentiella och regulatoriska lättare kedjor associerade.
Huvuddomänen är globulärt formad och innehåller både en ATP-bindande ficka och en aktinbindande ficka. Nackdomänen är omsluten och stabiliserad av olika lätta kedjor. Beroende på antalet lätta kedjor som omsluter myosinet, kan nackdomänen göras längre eller kortare. Detta leder till att det specifika myosinet får olika egenskaper. Svansdomänen ger de olika myosinerna affinitet till de olika vesiklarna, organellerna eller vad just det specifika myosinet än ska binda.
Hos exempelvis medlemmar i myosinfamiljen myosin II är två myosinmolekyler hoptvinnade till en större polypeptid. Till nackdomänen hos vardera av de enskilda polypeptiderna är en essentiell och en regulatorisk lätt kedja associerad. Myosin II består därför av totalt sex polypeptider.
Utöver myosin II finns en mängd andra myosinfamiljer, bland andra myosin I och myosin V. Totalt finns omkring 40 olika gener som kodar för olika myosiner i det mänskliga genomet. De flesta av alla myosiner rör sig mot den positiva änden av aktinfilament, men undantaget till detta är gruppen myosin VI, vilka rör sig i motsatt riktning. Den motsatta rörelseriktningen är ett resultat av att myosin VI har en litet förändrad huvuddomän.
Då muskelkontraktion utförs av myosiner är rörelser i myosinerna ett relativt välstuderat fenomen, eftersom muskelkontraktion är en cellulär process som lätt är observerbar. I sitt ursprungsläge sitter myosin bundet till filamentärt aktin och till ADP. När sedan en molekyl ATP binder till myosinets huvud, släpper myosinet från aktinet. När detta skett, hydrolyseras ATP till ADP och Pi. Detta inducerar en konformationsförändring i myosinet, vilket får myosinets aktinbindande ficka att förflytta sig längs med aktinet. När denna konformationsförändring är gjord, binder myosinet återigen till aktin. Detta får den bundna Pi att släppa från myosinet, vilket i sin tur utlöser ett kraftslag. Detta innebär att myosinet släpper sin elastiska energi och rätar på sig, något som får antingen det bundna aktinet att flytta på sig eller att myosinet flyttar på sig längs aktinfilamentet.
Det finns olika sätt myosin kan färdas längs aktinfilament. I fallet med myosin II, vilket återfinns i exempelvis muskler, ligger många myosinmolekyler tillsammans i tjocka fibrer. Detta innebär att det finns många tillgängliga myosinhuvud vid ett specifikt tillfälle. Detta gör att medlemmar i myosin II-familjen drar dig framåt längs aktinfilamentet med många huvuden samtidigt. Medlemmar i myosin V-familen, vilka är uppbyggda av två hoptvinnade myosinkedjor, rör sig istället genom att det ena huvudet är bundet till aktin medan det andra förflyttar sig från att vara bakom det andra huvudet till att vara framför för att sedan binda och låta det andra huvudet göra detsamma.
Myosiner kan förekomma i en mängd olika strukturer. För att kunna förmedla muskelkontraktion med hög fart, stor längd och tillräcklig kraft för att kunna klara stora belastningar krävs specifika strukturer. Olika situationer kräver olika former av specialiserade myosinkomplex, som exempelvis den kontraktila ringen vid cytokinesen eller de strukturer som uppkommer då cellen ska gå in i apoptos.
De strukturer som förmedlar muskelkontraktion kallas myofibriler. Dessa återfinns i knippen i muskelceller och dessa är i sin tur uppbyggda av tusentals strukturer med namnet sarkomerer. En sarkomer är ca 2 µm lång i sitt vilande stadium, men kan förkortas ned till ca 600 nm. Detta kan ske tack vare att sarkomererna är uppbyggda av aktinfilament bundna med sina positiva ändar till sarkomerernas båda ändar, den så kallade z-skivan, med myosin II-filament, som drar samman aktinfilamenten.
För att stabilisera denna struktur finns ett antal stödjande proteiner. Några av dessa är CapZ, tropomodulin, nebulin och titin. CapZ sitter på aktinets positiva ände, tropomodulin på aktinets negativa ände och nebulin längs hela aktinet. Titin sitter istället bundet till z-skivan och sträcker sig till mitten av myosinfilamentet, vilket antas hålla fast myosinet i mitten av sarkomeren.
För att inte musklerna ska kontrahera okontrollerat finns ett antal regulatorer. Den viktigaste av dessa är kalciumjonen. Denna återfinns vanligtvis i låg koncentration inuti cellen. För att bibehålla en låg koncentration i cytoplasman, pumpas kalciumjoner in i muskelcellernas ER, det sarkoplasmatiska nätverket. När sedan en nervimpuls inkommer, öppnas porer i SR, vilket leder till att kalciumjoner frisläpps. Kalciumjonerna binder till att två andra proteiner, tropomyosin och troponin, vilka i normalfallet sitter bundna till aktin och blockerar myosin från att binda. När kalciumjonerna bundit induceras en förändring i dessa två proteiner, något som gör det möjligt för myosin att åter binda.
Utöver att vara involverade i muskelkontraktion är myosin II-familjen även involverad i en mängd andra olika kontraktila knippen. Dessa är uppbyggda på liknande sätt som myofibrilerna, men mindre välorganiserade samt att de saknar den regulatoriska enheten troponin. Några exempel på sådana kontraktila knippen är den kontraktila ringen, vilken uppkommer vid cytokines samt olika stressfibrer.
Dessa typer av kontraktila fibrer använder sig inte av samma regulatoriska system som myofiblirerna gör, utan i dessa kontraktila fibrer skötes regleringen av fosforylering och defosforylering. När dessa kontraktila fibrer är i sitt vilande stadium, befinner sig myosinet i ett veckat stadium. För att räta på denna krävs att den regulatoriska lätta kedjan fosforyleras, vilket sker med hjälp av myosin LC kinas. Denna aktiveras calmodulin-Ca2+-komplex, vilken finns tillgängligt i proportion med mängden fria kalciumjoner. När calmodulin-Ca2+-komplexet blir inaktivt och faller bort, blir även myosin LC kinaset inaktivt. Myosin LC fosfatas återställer därefter myosinet till sitt vilande och veckade stadium.
—
Detta referat har en presentation associerad till sig. Denna hittar ni på gustavtallberg.se/projekt/myosin